Nitrogenoksid
I dagens verden har Nitrogenoksid blitt et tema med stor interesse og relevans. Det er et tema som har fanget oppmerksomheten til mange mennesker og har skapt debatt på ulike områder. I denne artikkelen vil vi grundig utforske Nitrogenoksid og dens implikasjoner i dagens samfunn. Vi vil analysere de historiske, sosiale, kulturelle og vitenskapelige aspektene knyttet til Nitrogenoksid, med sikte på å tilby en komplett og mangefasettert visjon om dette temaet. I tillegg vil vi undersøke de mulige implikasjonene og utfordringene som Nitrogenoksid presenterer i dagens verden, samt mulighetene og løsningene som kan oppstå fra studien. Gjennom denne artikkelen er den ment å bidra til berikelse av kunnskap og forståelse om Nitrogenoksid, og gi et informativt og reflektert perspektiv som inviterer til refleksjon og dialog rundt dette temaet.
Nitrogenoksider (NOX) er kjemisk forbindelser av oksygen og nitrogen. Nitrogenoksider løser seg lett i vann og danner salpetersyre.
Nitrogenoksider oppstår på flere måter, noen av de vanlige er under forbrenning der N og O slår seg sammen til å lage NO og NO2. Andre måter er under reaksjoner med salpetersyre eller nitratsalter kan NOx gasser dannes.
Atmosfæren
I atmosfæren er det små mengder av NO2 og NO i fra hovedsakelig biler og industrielle produksjoner.[1] Sollys katalyserer reduksjon av N i reaksjonen NO2 til NO. Nitrogenoksid er, sammen med svovel, derfor en viktig bidragsyter til sur nedbør.
Ulike oksidasjonstrinn for N
Nitrogen kan ha alle oksidasjonstall fra +5 til -3.
NOx kan bety følgende oksider (oksygen forbindelser) av nitrogen, eller en blanding:
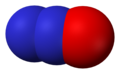
- Nitrogenmonoksid (NO), nitrogen(II)oksid
- Nitrogendioksid (NO2)
- Dinitrogenmonoksid (N2O), nitrous oxide
- Dinitrogentrioksid (N2O3), nitrogen (III) oxide
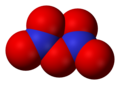
- Dinitrogentetroksid (N2O4)
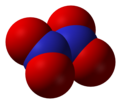
- Dinitrogenpentoksid (N2O5)
-
Nitrogenoksid, NO
-
Nitrogendioksid, NO2
-
Dinitrogenmonoksid, N2O
-
Dinitrogentrioksid, N2O3
-
Dinitrogen tetroksid, N2O4
-
Dinitrogen pentoksid, N2O5
Forurensning
Oksider av nitrogen og svovel i atmosfæren skyldes for en stor del forurensning av luften som kalles fotokjemisk smog.
Referanser
- ^ «Nitrogendioksid». Folkehelseinstituttet (på norsk). Besøkt 8. mars 2023.